Análisis conformacional de un fragmento peptídico del primer bucle extracelular del receptor tipo 1 de angiotensina humano
DOI:
https://doi.org/10.33017/RevECIPeru2017.0009/Palabras clave:
Receptor AT1 humano, dicroísmo circular, micelas, vesículas unilamelares grandesResumen
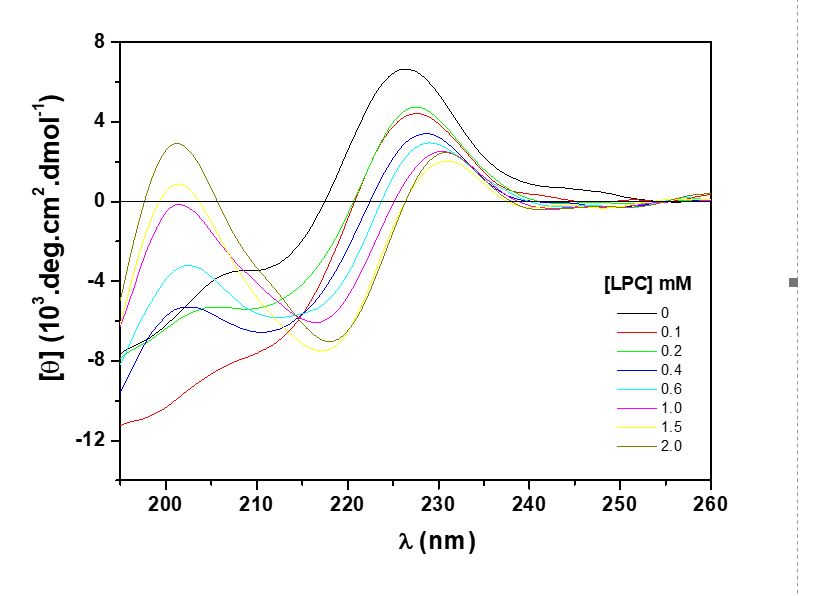
El receptor tipo 1 de angiotensina (AT1) es mediador importante de las funciones vasoconstrictoras de la angiotensina II. Durante el proceso de activación del receptor, éste sufre alteración estructural que conlleva al proceso de transducción de señal. En el presente estudio se investigaron las propiedades conformacionales del fragmento peptídico Ac-YRWPFGNYL-CONH2 (fEC1) correspondiente al primer bucle extracelular del receptor AT1 humano tanto en medio acuoso como en la presencia de sistemas que mimetizan la membrana biológica. De esta manera, se utilizaron micelas y vesículas unilamelares grandes (LUV) -tanto de naturaleza aniónica como zwitteriónica- como sistemas biomiméticos. Las micelas fueron preparadas a partir de los lisofosfolípidos: 1-palmitoil-2-hidroxi-fosfatidilcolina (LPC) y 1-palmitoil-2-hidroxi-fosfatidilglicerol (LPG), mientras que, las LUV fueron preparadas a partir de 1-palmitoil-1-oleoil-fosfatidilcolina (POPC) y 1-palmitoil-2-oleoil-fosfatidilglicerol (POPG). El péptido fue sintetizado por el método de síntesis en fase sólida y los análisis conformacionales fueron realizados mediante dicroísmo circular. Los experimentos fueron realizados en pH 7.0. En este pH la carga teórica de fEC1 es +1. El espectro de dicroísmo circular de fEC1 en solución presentó una banda positiva en aproximadamente 226 nm, mientras que, en la presencia de micelas zwitteriónicas y aniónicas y, en la presencia de LUV aniónicas fueron observadas alteraciones espectrales, esto es, la adquisición de estructura secundaria del péptido como consecuencia de la interacción péptido-sistema biomimético.