Interacción entre un fragmento peptídico del receptor tipo 1 de angiotensina humano y sistemas miméticos de membrana biológica
DOI:
https://doi.org/10.33017/RevECIPeru2016.0003/Palabras clave:
Receptor AT1 humano, dicroísmo circular, fluorescencia, sistema mimético de membrana biológicaResumen
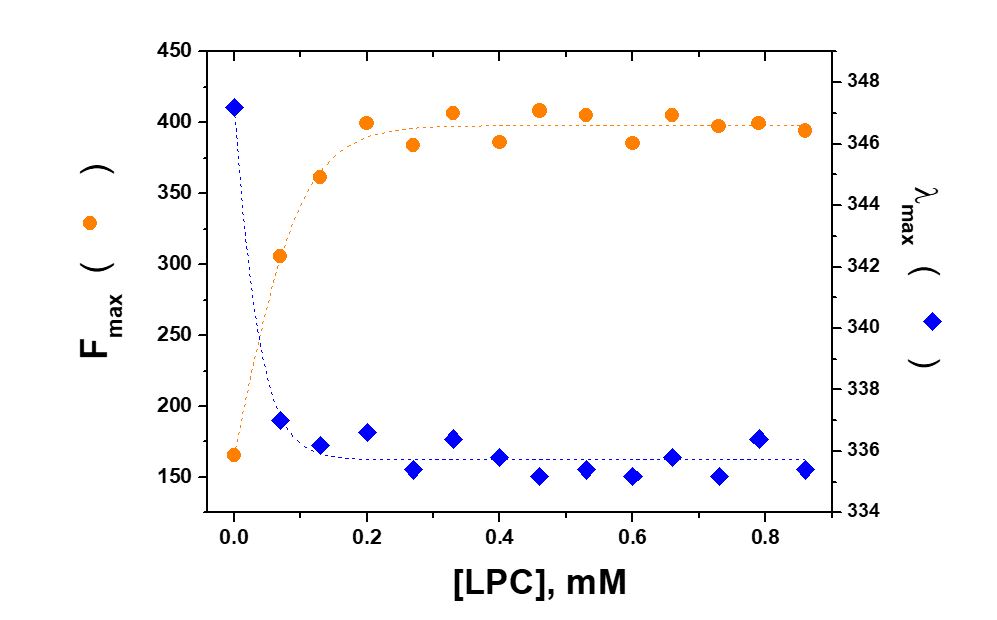
El receptor tipo 1 de angiotensina (AT1) humano pertenece a la superfamilia de receptores acoplados a Proteínas G (GPCR). Estudios conformacionales de fragmentos peptídicos de GPCR requiere el uso de sistemas que mimeticen el ambiente del receptor. El presente estudio propone investigar la interacción del fragmento peptídico Ac-YRWPFGNYL-CONH2 (fEC1), que corresponde a los residuos de aminoácidos 92 -100 del primer bucle extracelular del receptor AT1 humano, con sistemas miméticos de membrana biológica -micelas y vesículas unilamelares grandes (LUV). Las micelas fueron preparadas a partir de los lisofosfolípidos: 1-palmitoil-2-hidroxi-fosfatidilcolina (LPC) y 1-palmitoil-2-hidroxi-fosfatidilglicerol (LPG), mientras que, las LUV fueron preparadas a partir de 1-palmitoil-2-oleoil-fosfatidilcolina (POPC) y 1-palmitoil-2-oleoil-fosfatidilglicerol (POPG). El péptido fEC1 fue sintetizado por el método de síntesis en fase sólida. Se realizaron medidas de fluorescencia utilizando, como sonda fluorescente intrínseca, el residuo de triptófano (W94), presente en la secuencia de aminoácidos de fEC1. La longitud de onda de excitación (lexc) fue de 195 nm. Los espectros de fluorescencia de fEC1 (10 mM) fueron obtenidos en concentraciones crecientes de lisofosfolípidos o de fosfolípidos. La intensidad de fluorescencia del péptido aumentó en la presencia de micelas tanto zwitteriónica (LPC) como aniónica (LPC: LPG, mol:mol) y, en la presencia de LUV aniónica (POPC:POPG, mol:mol). Asimismo, se observaron desplazamientos de las longitudes de onda de emisión máxima (lmax) hacia el azul. Las alteraciones espectrales observadas son debido a la sensibilidad del triptófano a la polaridad del medio en que se encuentra. A partir de las isotermas de interacción fueron determinadas las constantes de asociación (Ka). De acuerdo a estos valores, la interacción del péptido con los sistemas aniónicos fue mayor que con los zwitteriónicos debido a la contribución de fuerzas electrostáticas. Para los estudios de supresión de fluorescencia se utilizó acrilamida como supresor colisional y se determinaron las constantes de Stern-Volmer. Conforme a estos valores, el fluoróforo está más expuesto a la acrilamida cuando fEC1 está en solución que cuando está en la presencia de sistemas biomiméticos, lo cual es debido a la interacción del péptido con estos sistemas. Asimismo, se calcularon los valores de anisotropía de fluorescencia (r) los cuales están relacionados al movimiento de difusión rotacional de un fluoróforo. De acuerdo a estos datos, el péptido presenta mayor movimiento de difusión rotacional en medio acuoso que cuando interactúa con los sistemas modelo. Los resultados obtenidos, a través de la fluorescencia de estado estacionario, muestran la interacción del fragmento peptídico fEC1 con micelas de lisofosfolípido, LUV de POPC: POPG y, en menor extensión, con LUV de POPC.